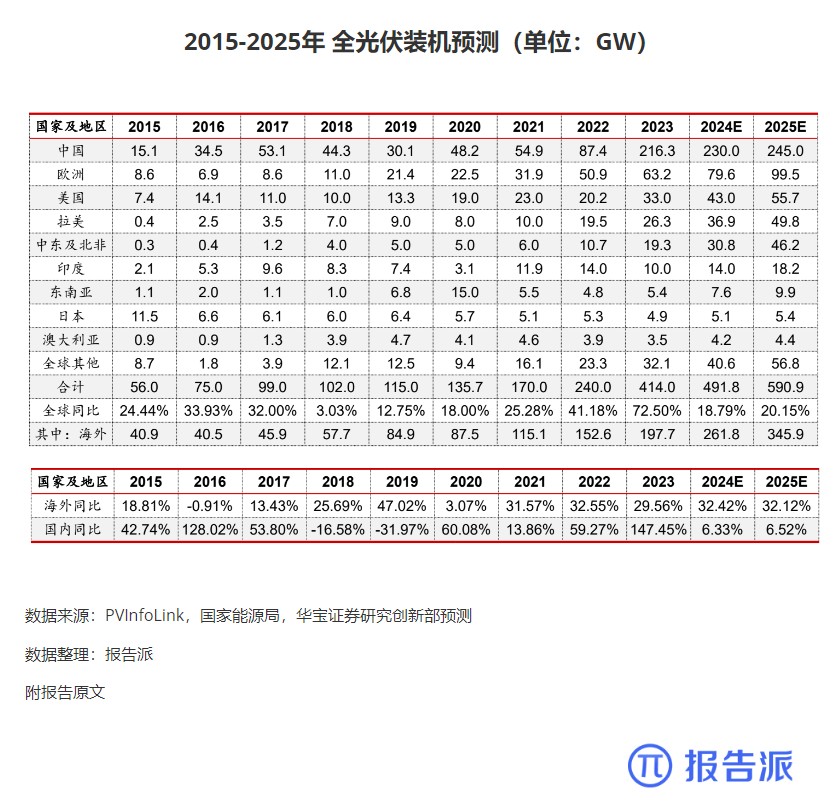
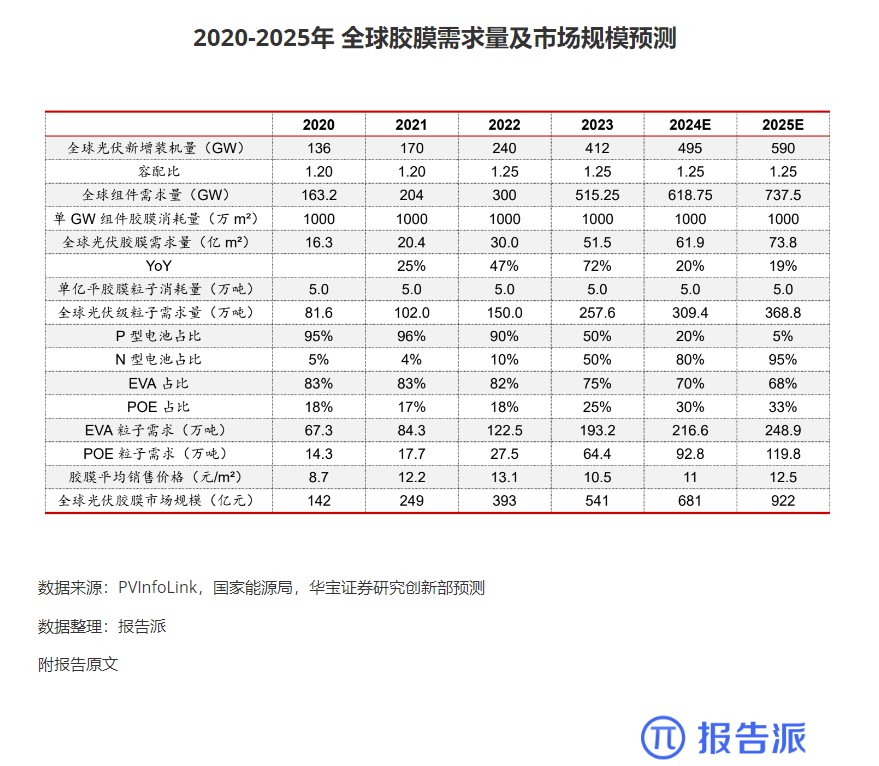
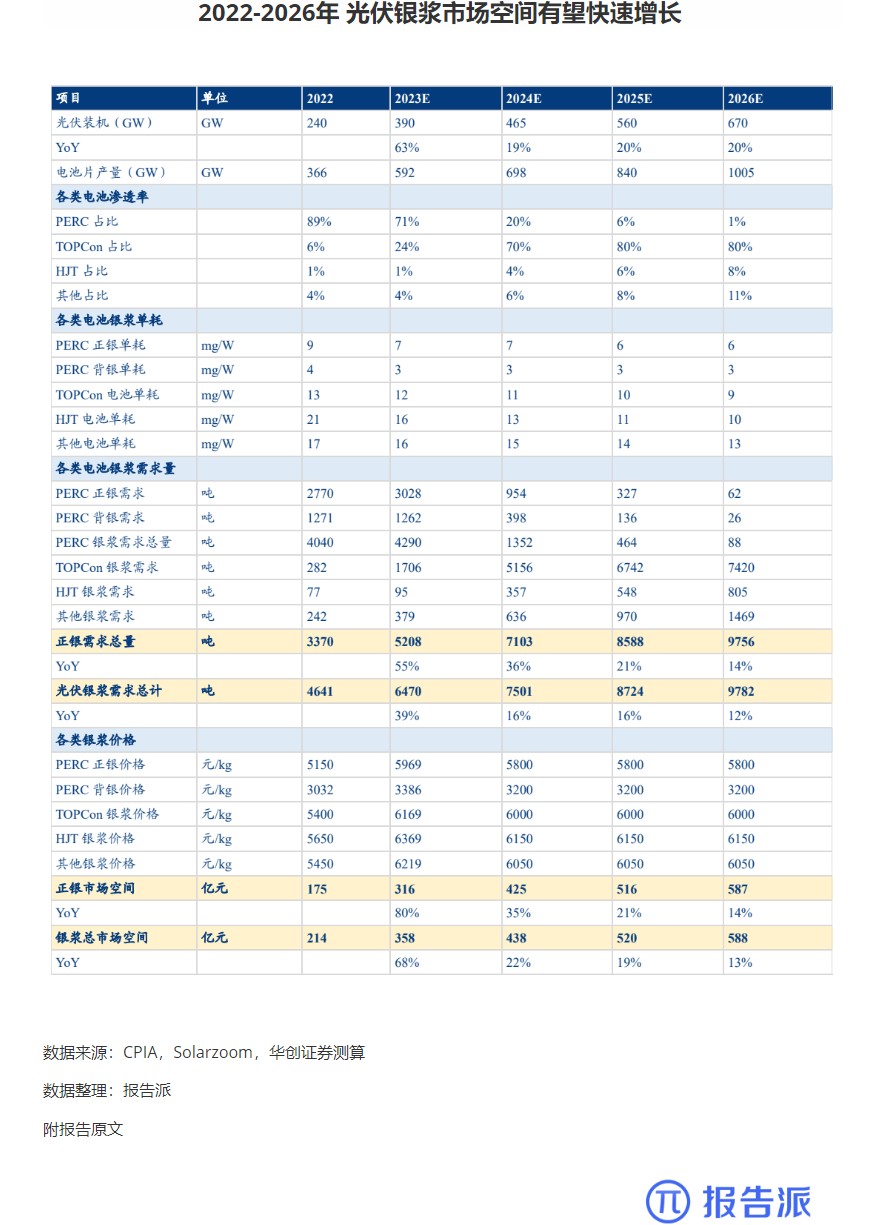
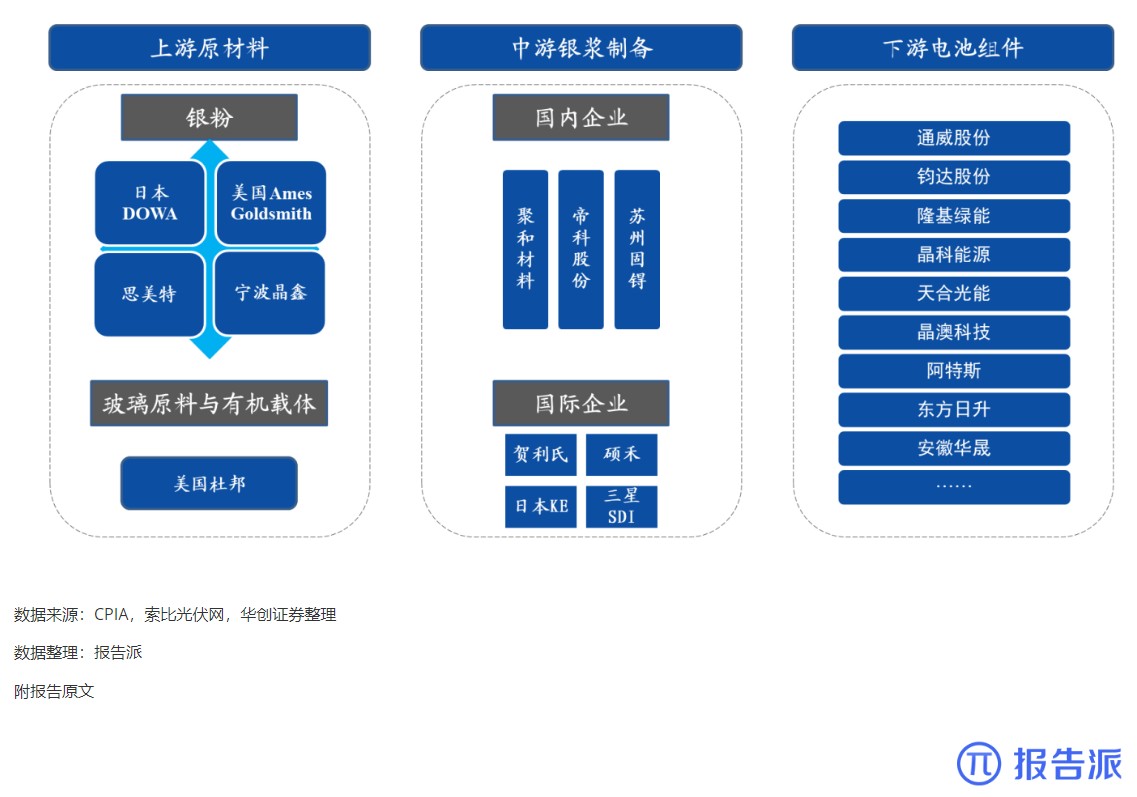
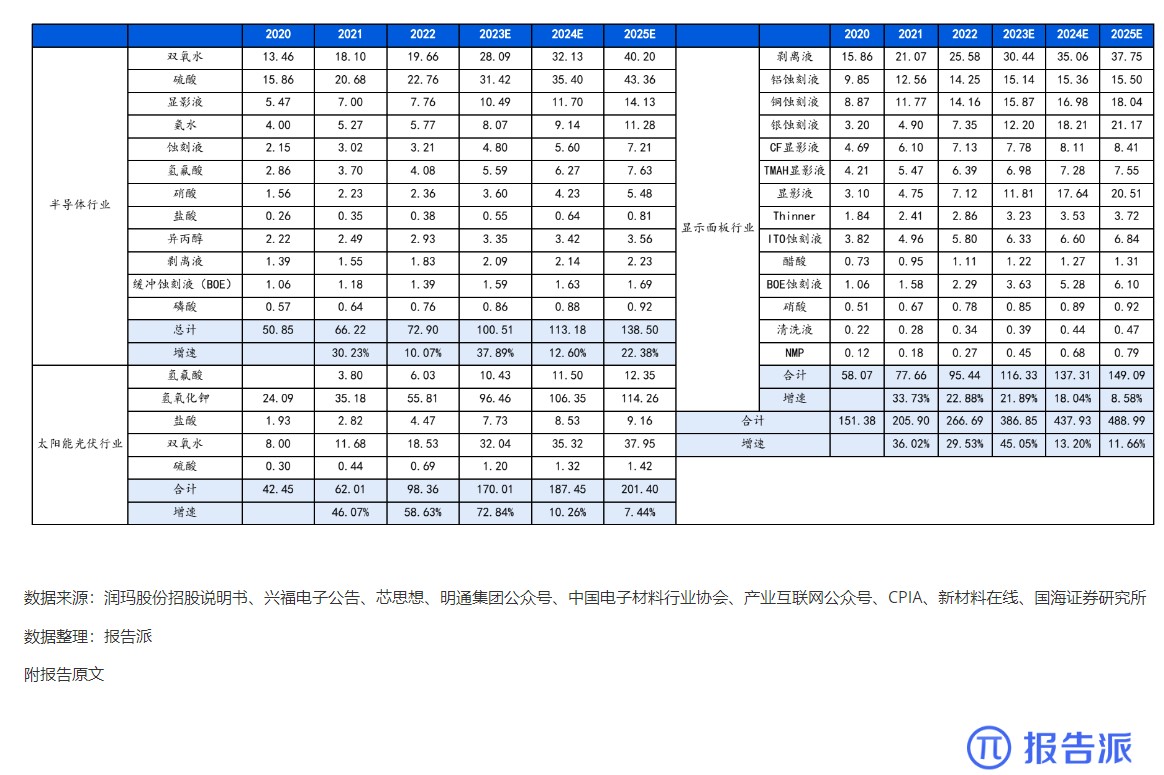
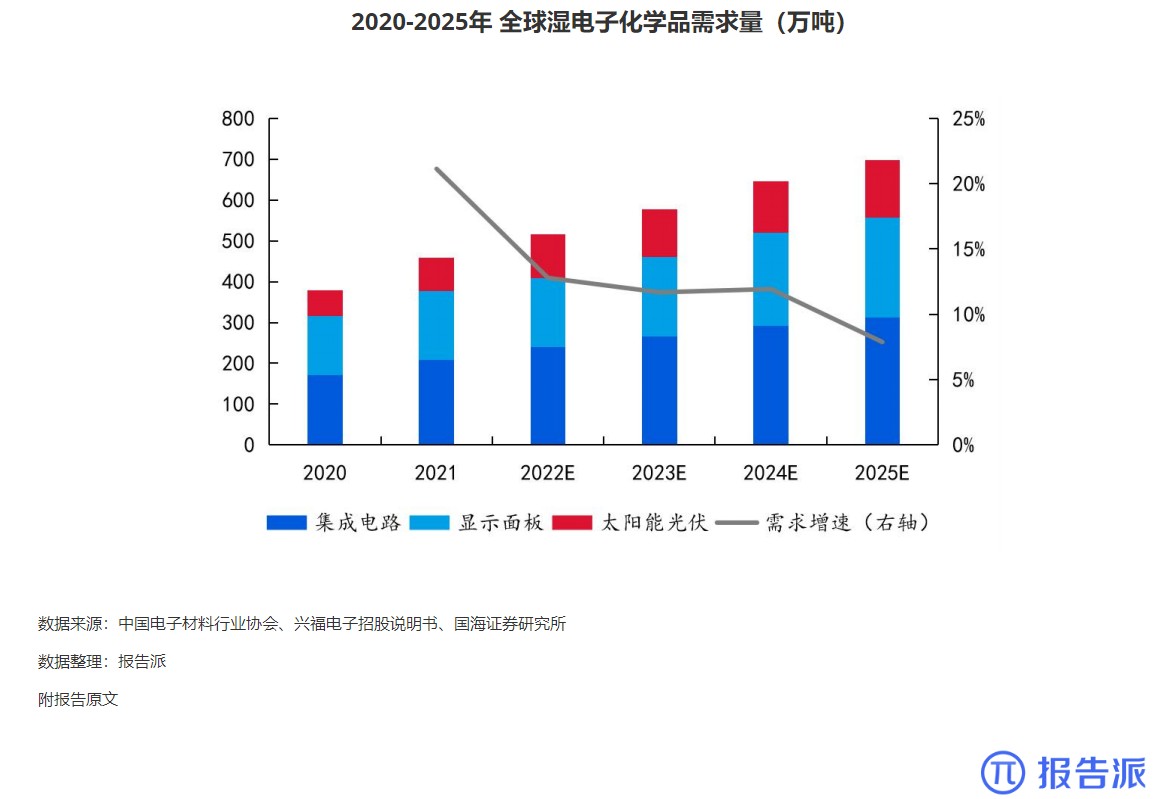
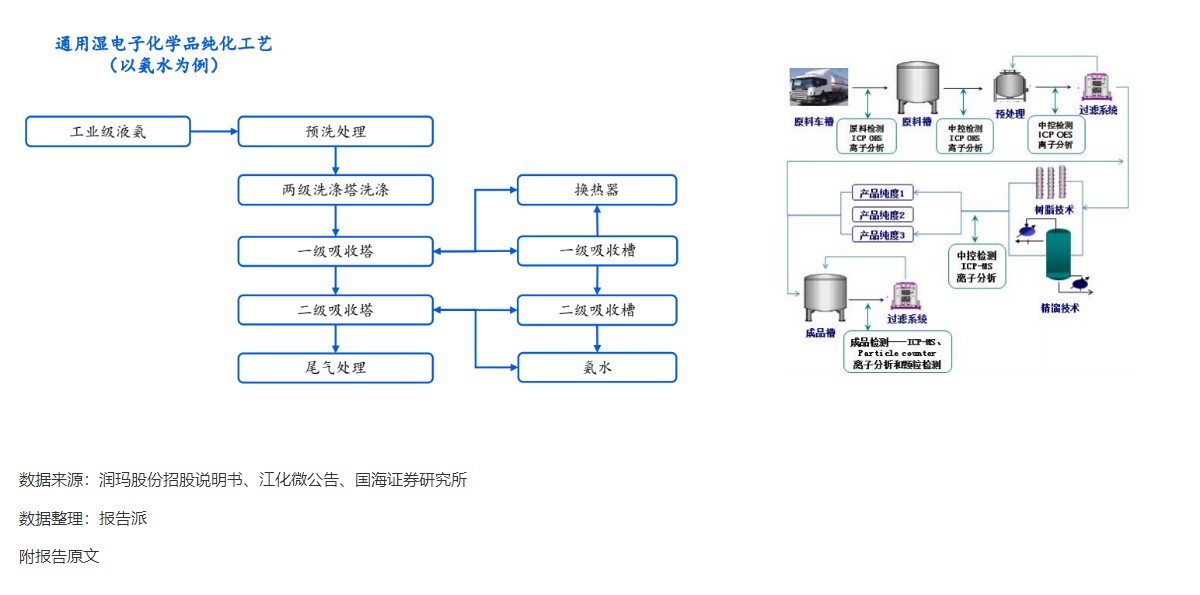
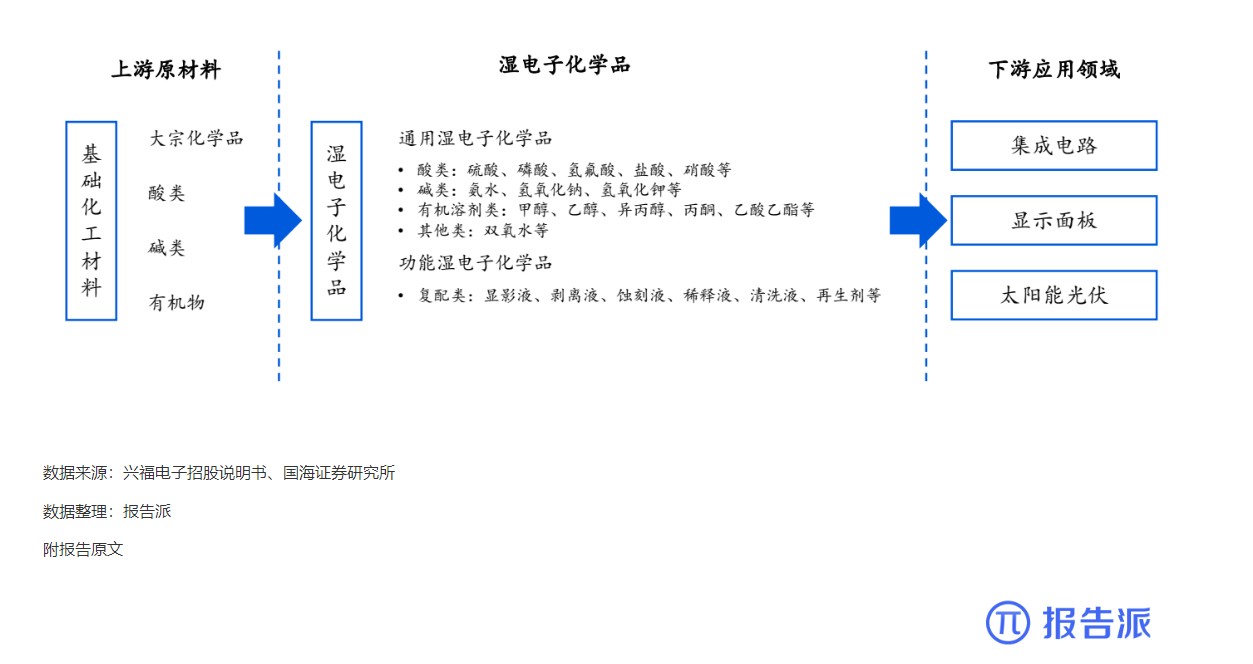
| Revumenib 是一种口服小分子 Menin- 混合谱系白血病 1 (MLL1) 抑制剂,对 MLL 重排和核磷蛋白 1 (NPM1) 突变的白血病有效。 2023 年 12 月,Syndax Pharmaceu cals 宣布根据美国食品药品监督管理局 (FDA) 实时肿瘤学评审 (RTOR) 计划提交 Revumenib 新药申请 (NDA),用于治疗成人和儿童复发或难治性 (R/R) KMT2A 重排(KMT2Ar) 急性白血病。 关键性 I/II 期 AUGMENT-101 研究数据为该申请提供了支持。 I/II 期 AUGMENT-101 研究在复发性 / 难治性 KMT2Ar 或 NPM1 突变的 AML 和急性淋巴细胞白血病 (ALL) 患者中评估了 Revumenib。 2023 年 12 月首次公布的 AML 组试验结果令人鼓舞,该药物在 KMT2Ar 人群中达到了较高的完全缓解/完全缓解伴部分血液学恢复 (CR/CRh) 率,这尤其令人印象深刻,因为患者之前曾多次复发,其中 72% 曾接受过 Venclexta 治疗。 12 例患者在造血干细胞移植 (HSCT) 和 Revumenib 维持治疗后维持复合完全缓解,6 例患者在截止时维持微小残留病 (MRD) 阴性缓解,1 例患者从 MRD 阳性转为 MRD 阴性。 3 例患者在移植后接受 Revumenib 维持治疗一年以上,维持治疗的安全性特征良好。 Venclexta 与低甲基化药物或低剂量阿糖胞苷联合使用,是当前不适合强化化疗的初治 AML 患者的标准治疗,但 Venclexta 治疗后复发患者的治疗选择有限。 骨髓移植是唯一的治愈选择,在这种情况下,任何治疗的目的都是达到允许移植的稳定缓解,而由于 Revumenib 可产生有临床意义的持久缓解,因而非常具有前景。 2024 年 3 月,Syndax 宣布美国 FDA 已授予 NDA 优先评审资格,处方药用户付费法案 (PDUFA) 目标行动日期指定为 2024 年 9 月 26 日。
|